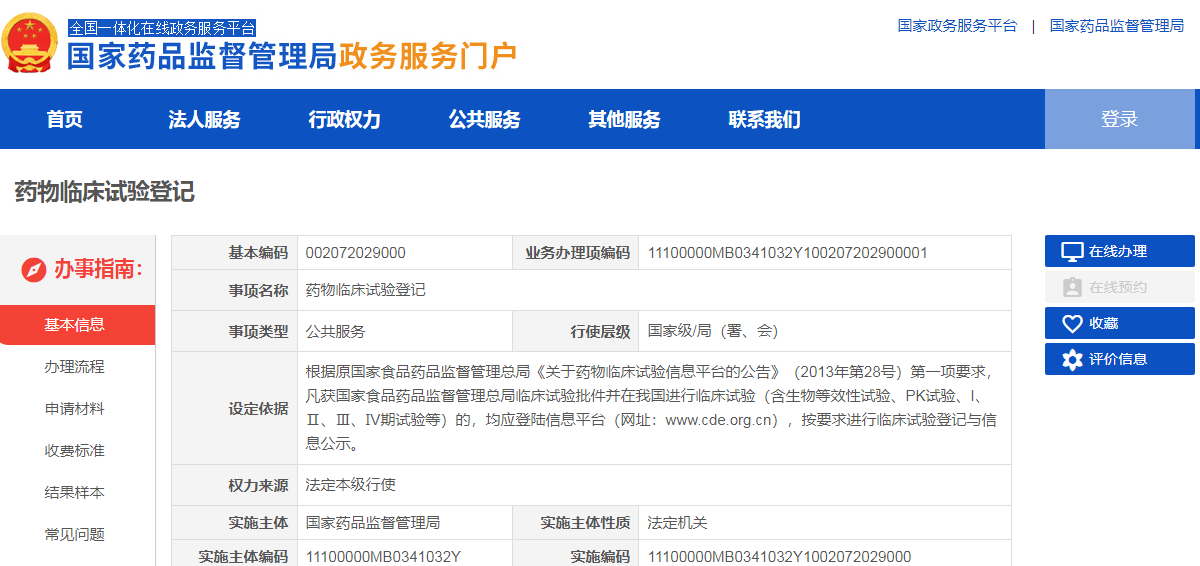
根据原国家食品药品监督管理总局《关于药物临床试验信息平台的公告》(2013年第28号)第一项要求,凡获国家食品药品监督管理总局临床试验批件并在我国进行临床试验(含生物等效性试验、PK试验、I、Ⅱ、Ⅲ、Ⅳ期试验等)的,均应登陆信息平台(网址:www.cde.org.cn),按要求进行临床试验登记与信息公示。
申请人需符合以下任意一种条件:
1.获得药物临床试验批件;
2.获得临床试验通知书;
3.已在化学仿制药生物等效性与临床试验备案信息平台备案, 并获得备案号;
4.根据监管部门通知和要求需开展的临床试验,如IV期临床试验、有条件批准上市药品需进行的临床试验等。
申请流程文字说明
申请人可登录网站http://www.chinadrugtrials.org.cn,参考最新版《药物临床试验登记填写指南》(下称“填写指南”)和《药物临床试验登记与信息公示平台使用说明》(下称“使用说明”)的详细要求进行操作。
第一步,注册帐号:登录上述网站,按操作说明注册帐号并登录。如已在化学仿制药生物等效性与临床试验备案信息平台备案并获得备案号的,需使用“申请人之窗”帐号登录。
第二步,预登记:申请人上传《药物临床试验批件》或《临床试验通知书》(已在化学仿制药生物等效性与临床试验备案信息平台备案并获得备案号的,系统将自动关联,该步骤可省略);
第三步,增加临床试验,并填写试验相关信息并递交审核;
第四步,药品审评中心进行信息审核,如不符合填写指南要求将退回申请人修改; 第五步,信息公示。 如后续有信息更新,申请人更新信息并递交审核后,将再按照上述第四、五步骤进行。

申请材料名称
1.药物临床试验批件或临床试验通知书或化学仿制药生物等效性与临床试验备案号:复印件/申请人自备,电子版1份。
2.题目和背景信息:复印件/申请人自备,电子版1份。
3.申办者信息:复印件/申请人自备,电子版1份。
4.临床试验信息:复印件/申请人自备,电子版1份。
5.试验伤害保险(如适用):复印件/申请人自备,电子版1份/次。
6.第一例受试者入组日期(含国内和国际):复印件/申请人自备,电子版1份。
7.试验终止日期(含国内和国际):复印件/申请人自备,电子版1份。
8.研究者信息:复印件/申请人自备,电子版1份。
9.伦理委员会信息:复印件/申请人自备,电子版1份/次。
10.历次伦理批件(首次伦理审批需包含批件、批准文件清单、伦理委员会成员签字表):复印件/申请人自备,电子版1份/次。
11.与伦理批件对应的全部知情同意书:复印件/申请人自备,电子版1份/次。
12.试验状态:复印件/申请人自备,电子版1份。
13.试验信息的登记人及联系方式(姓名、电话、Email、邮政地址、邮编、单位名称、相关说明):复印件/申请人自备,电子版1份。
14.其他说明文件(如适用):复印件/申请人自备,电子版1份/次。